✓ Automatische Verarbeitung von Online-Bestellungen 24/7
✓ Sachkundiger und professioneller technischer und Produkt-Support
✓ Schnelle und zuverlässige (Nach-)Bestellung
Cat. No. / ID: 34850
✓ Automatische Verarbeitung von Online-Bestellungen 24/7
✓ Sachkundiger und professioneller technischer und Produkt-Support
✓ Schnelle und zuverlässige (Nach-)Bestellung
Eigenschaften
- Ausgezeichnete Ergebnisse bei Dot- und Western-Blotting-Verfahren
- Hochsensitiver und -spezifischer Nachweis
Angaben zum Produkt
Leistung
Abbildungen ansehen
Prinzip
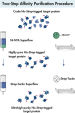
Das Two-Step Affinity Purification System, welches auf dem bewährten 6xHis-tag und dem kurzen Strep-tag II basiert, ermöglicht die einfache und effiziente Aufreinigung ultrareiner Proteine in einem schnellen und standardisierten Verfahren. Rekombinante Proteine, die mit beiden Tags markiert sind, werden sequenziell an Ni-NTA- und Strep-Tactin-Matrizes aufgereinigt (siehe Abbildung Ultrareines Protein in zwei Schritten). Die beiden Affinitätsverfahren liefern ein vollständig aktives, ultrareines Volllängen-Protein, das sich für jede nachgelagerte Applikation eignet.
Abbildungen ansehen
Verfahren
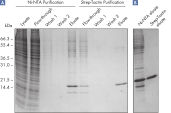
Rekombinante Proteine, die mit zwei kleinen Affinitätstags (6xHis-tag und Strep-tag II) markiert sind, lassen sich mithilfe von pQE-TriSystem His·Strep-Vektoren effizient in E. coli-, Insekten- oder Säugerzellen exprimieren. Nach der Zelllyse und der Klärung des Lysats werden die Proteine zunächst mit einem Verfahren der immobilisierten Metall-Affinitätschromatographie aufgereinigt, das auf der bewährten 6xHis-tag-Ni-NTA-Interaktion basiert. Nach der Elution von der Ni-NTA-Matrix mit Imidazol werden die rekombinanten Proteine (die auch das Epitop Strep-tag II tragen) direkt auf eine Strep-Tactin-Matrix geladen. Ein Pufferaustausch ist nicht erforderlich. Die Elution des Proteins von der Strep-Tactin-Matrix erfolgt entweder mit Biotin oder Desthiobiotin. Diese zweistufige Affinitätsaufreinigung liefert ultrareines (> 98 % reines) Protein (siehe Abbildung Zweistufiges Affinitätsaufreinigungsverfahren). Die Reihenfolge der Aufreinigungen kann vertauscht werden (d. h. zunächst Aufreinigung mit Strep-Tactin und anschließend mit Ni-NTA). Die Proteine können mit hoher Spezifität und Sensitivität mit monoklonalen Mausantikörpern gegen Strep-tag oder Anti-His-Antikörpern nachgewiesen werden.
Abbildungen ansehen
Anwendungen
Das zweistufige Affinitätsaufreinigungssystem, bei dem der Strep-tag-Antikörper zum Nachweis verwendet wird, eignet sich optimal für Applikationen, bei denen eine hohe Reinheit besonders wichtig oder schwer zu erzielen ist. Das standardisierte Aufreinigungsverfahren steigert auch den Durchsatz, indem es die Entwicklung und Optimierung eines proteinspezifischen Aufreinigungsprotokolls überflüssig macht. Die durch das zweistufige Affinitätsaufreinigungssystem ermöglichte ultrahohe Reinheit und die einfache Handhabung machen es zur Methode der Wahl für:
- Struktur- und Funktionsanalysen
- Expression in eukaryotischen Systemen
Ergänzende Daten und Abbildungen
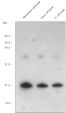
Highly sensitive detection of proteins carrying a Strep-tag.

Specifications
| Features | Specifications |
|---|---|
| Applications | Western Blot, Dot Blot, Immunpräzipitation, Immunhistochemie |
| Detection | Sekundärantikörper erforderlich |
| Sensitivity in Western blots (chemiluminescent detection) | 1 ng |
| Substrate for blot detection | Abhängig vom Sekundärantikörper |
| Substrates for assay procedure | Abhängig vom Sekundärantikörper |
| Tag | Strep-tag |
| Epitope detected | SAWSHPQFEK |