✓ Traitement automatique des commandes en ligne 24 h/24 7 j/7
✓ Assistance technique et produits pertinente et professionnelle
✓ Commande (ou réapprovisionnement) rapide et fiable
HiSpeed Plasmid Midi Kit (25)
N° de réf. / ID. 12643
✓ Traitement automatique des commandes en ligne 24 h/24 7 j/7
✓ Assistance technique et produits pertinente et professionnelle
✓ Commande (ou réapprovisionnement) rapide et fiable
Caractéristiques
- Temps de préparation intérieur à 60 minutes
- Nettoyage des lysats et précipitation à l’isopropanol sans centrifugation
- Aucun risque de perte de culot d’ADN lors de la précipitation
- Rendement de 750 µg maximum d’ADN plasmidique à nombre de copies élevé
- LyseBlue pour lyse optimale et rendement d’ADN maximal
- Préparation de plasmides à grande échelle sans collecteur de vide
Détails produit
Les HiSpeed Plasmid Kits fournissent une préparation d’ADN plasmidique rapide et à grande échelle par échange d’anions sans centrifugation. L’ADN purifié équivaut à celui obtenu par une double centrifugation en gradient de CsCl et est adapté aux applications de qualité de transfection.
Performances
Les HiSpeed Plasmid Kits contiennent des QIAfilter Cartridges, des HiSpeed Tips et des modules QIAprecipitator pour une préparation rapide et à grande échelle de plasmides avec un collecteur de vide. Les modules QIAfilter et QIAprecipitator en format de seringue remplacent les étapes de centrifugation dans la procédure classique d’échange d’anions, accélérant ainsi la purification de plasmides et améliorant sa praticité. Une quantité maximale de 750 µg (maxi) ou 200 µg (midi) d’ADN plasmidique à nombre de copies élevé peut être purifiée à partir d’une culture comprise entre 150 ml à 250 ml ou 50 ml à 150 ml respectivement (les volumes de culture dépendent du nombre de copies plasmidiques, de la taille de l’insert, de la souche hôte et du milieu de culture). La conception du HiSpeed Tip permet un débit très élevé, ce qui accélère les étapes de liaison, de lavage et d’élution de l’ADN pour la purification de plasmides.
La résine échangeuse d’anions unique des HiSpeed Tips est élaborée exclusivement pour la purification des acides nucléiques. Ses propriétés de séparation exceptionnelles produisent un ADN dont la pureté est égale ou supérieure à celui obtenu par deux cycles successifs de centrifugation en gradient de CsCl.
Principe
Les QIAfilter Cartridges (voir la figure « QIAfilter Cartridge ») sont des unités de filtre spéciales conçues pour remplacer l’étape de centrifugation après la lyse alcaline des cellules bactériennes. Les QIAfilter Cartridges éliminent complètement les précipités du SDS et nettoient les lysats bactériens en une fraction du temps nécessaire à la centrifugation. Les HiSpeed Tips préemballés fonctionnent par écoulement par gravité et ne s’assèchent jamais, ce qui réduit le temps de manipulation nécessaire à la préparation des plasmides.
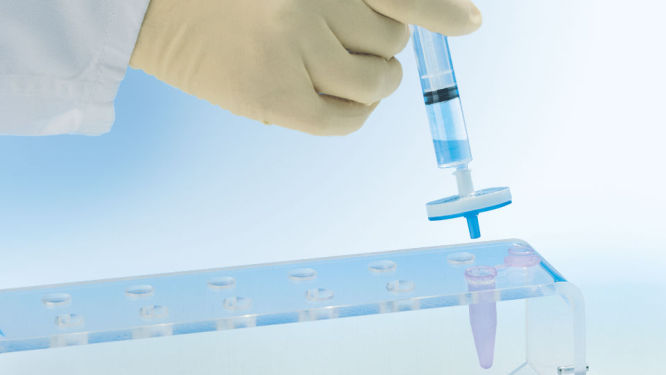
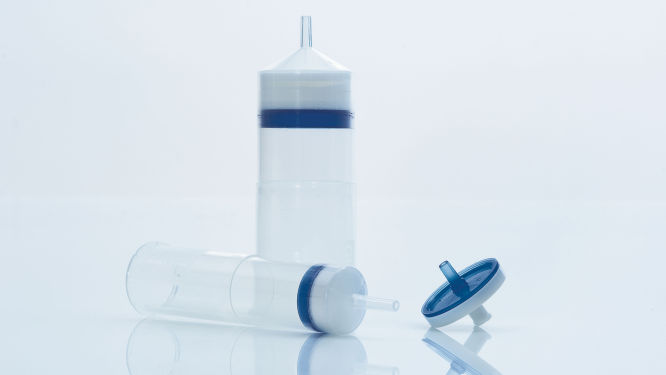
Le module QIAprecipitator unique (voir la figure « Module QIAprecipitator ») remplace l’étape de centrifugation traditionnellement utilisée pour prélever l’ADN précipité dans l’isopropanol après la purification. Le module QIAprecipitator capture l’ADN précipité tandis que le mélange d’isopropanol et de tampon passe à travers. L’ADN est ensuite simplement élué à partir du QIAprecipitator dans un tube de microcentrifugation contenant un tampon TE ou de l’eau. Ce module unique élimine également le risque de perte du culot, qui peut survenir lors du décantage du surnageant après la précipitation.
| Fonctionnalités | HiSpeed Plasmid Midi Kit | HiSpeed Plasmid Maxi Kit |
|---|---|---|
| Applications | Transfection, clonage, séquençage, inactivation génique | Transfection, clonage, séquençage, inactivation génique |
| Volume de culture/matériel de départ | Volume de culture de 50 µl à 150 ml | Volume de culture de 150 µl à 250 ml |
| Type de plasmide | ADN plasmidique à nombre de copies élevé | ADN plasmidique à nombre de copies élevé |
| Traitement | Manuel (filtration) | Manuel (filtration) |
| Échantillon par cycle d’exécution | 1 échantillon par cycle d’exécution | 1 échantillon par cycle d’exécution |
| Technologie | Technologie d’échange d’anions | Technologie d’échange d’anions |
| Durée par cycle d’exécution | 45 min | 60 min |
| Rendement | < 200 µg | < 750 µg |
Procédure
Les lysats bactériens neutralisés sont incubés dans la QIAfilter Cartridge et sont nettoyés en quelques secondes par filtration. Le filtrat est appliqué à un HiSpeed tip pour la purification d’ADN plasmidique (voir le schéma « Procédures QIAGEN Plasmid Kit »). L’ADN élué est mélangé avec de l’isopropanol et appliqué au module QIAprecipitator à l’aide de la seringue fournie. L’ADN concentré et dessalé est ensuite élué à partir du QIAprecipitator directement dans un tube de microcentrifugation contenant un tampon TE ou de l’eau.
Applications
L’ADN purifié grâce aux HiSpeed Plasmid Kits produit d’excellents résultats dans toutes les applications, du clonage et du séquençage à la transfection et à l’inactivation génique à médiation plasmidique.
Données et illustrations utiles
Module QIAprecipitator.