✓ Automatische Verarbeitung von Online-Bestellungen 24/7
✓ Sachkundiger und professioneller technischer und Produkt-Support
✓ Schnelle und zuverlässige (Nach-)Bestellung
HiSpeed Plasmid Midi Kit (25)
Kat.-Nr. / ID. 12643
✓ Automatische Verarbeitung von Online-Bestellungen 24/7
✓ Sachkundiger und professioneller technischer und Produkt-Support
✓ Schnelle und zuverlässige (Nach-)Bestellung
Eigenschaften
- Präparationsdauer unter 60 Minuten
- Lysatbereinigung und Isopropanolausfällung ohne Zentrifugation
- Kein Risiko des Verlusts von DNA-Pellets beim Ausfällen
- Ausbeute von bis zu 750 µg Plasmid-DNA mit hoher Kopienzahl
- LyseBlue für optimale Lyse und maximale DNA-Ausbeute
- Plasmidpräparation im großen Maßstab ohne Vakuumverteiler
Angaben zum Produkt
HiSpeed Plasmid Kits ermöglichen eine schnelle, auf Anionenaustausch basierende Plasmid-DNA-Präparation in großem Maßstab ohne Zentrifugation. Die aufgereinigte DNA entspricht der durch zweimalige CsCl-Gradientenzentrifugation gewonnenen DNA und eignet sich für transfektionsfähige Anwendungen.
Leistung
HiSpeed Plasmid Kits enthalten QIAfilter Cartridges, HiSpeed Tips und QIAprecipitator Module für die schnelle Plasmidpräparation im großen Maßstab ohne Vakuumverteiler. Die QIAfilter und QIAprecipitator Module im Spritzenformat ersetzen die Zentrifugationsschritte im klassischen Anionenaustauschverfahren und beschleunigen und vereinfachen die Plasmidaufreinigung. Aus 150 µl – 250 ml bzw. 50 µl – 150 ml Kulturmedium können bis zu 750 µg (Maxi) bzw. 200 µg (Midi) Plasmid-DNA mit hoher Kopienzahl bereinigt werden (das Kulturvolumen hängt von der Plasmid-Kopienzahl, der Größe des Inserts, dem Wirtsstamm und dem Kulturmedium ab). Der Aufbau der HiSpeed Tips ermöglicht eine sehr hohe Durchflussrate, so dass die DNA-Bindung, das Waschen und die Elutionsschritte für die Plasmidaufreinigung schneller erfolgen können.
Das innovative Anionenaustauscherharz der HiSpeed Tips wurde ausschließlich für die Aufreinigung von Nukleinsäuren entwickelt. Seine hervorragenden Trenneigenschaften führen zu einer DNA-Reinheit, die der durch zwei aufeinanderfolgende Durchgänge der CsCl-Gradientenzentrifugation erzielten Reinheit gleichwertig oder überlegen ist.
Prinzip
QIAfilter Cartridges (siehe Abbildung „ QIAfilter Cartridge“) sind spezielle Filtereinheiten, die den Zentrifugationsschritt nach der alkalischen Lyse von Bakterienzellen ersetzen sollen. QIAfilter Cartridges entfernen SDS-Niederschlag vollständig und bereinigen Bakterienlysate in einem Bruchteil der für die Zentrifugation benötigten Zeit. Die vorverpackten HiSpeed Tips arbeiten nach dem Schwerkraftprinzip und trocknen nie aus, was den Zeitaufwand für die manuelle Plasmidpräparation minimiert.
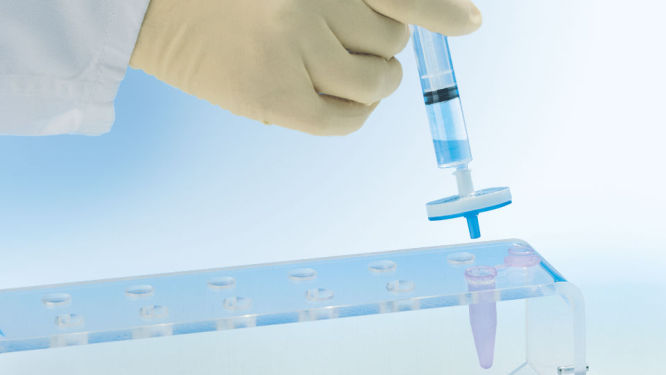
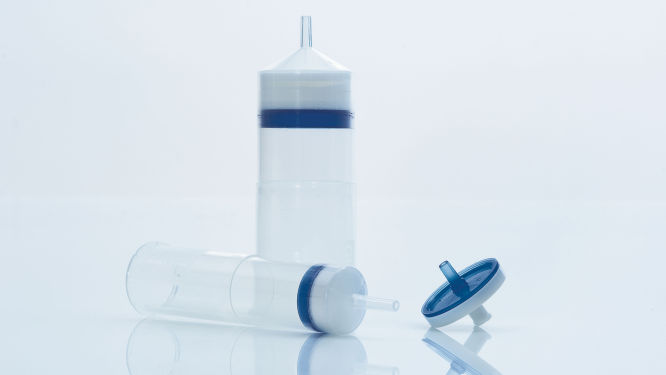
Das neuartige QIAprecipitator Modul (siehe Abbildung „ QIAprecipitator Modul“) ersetzt den Zentrifugationsschritt, der traditionell zum Auffangen der mit Isopropanol ausgefällten DNA nach der Aufreinigung dient. Das QIAprecipitator Modul scheidet die ausgefällte DNA ab, während das Isopropanol-Puffergemisch durch das Modul strömt. Die DNA wird dann einfach aus dem QIAprecipitator in ein Mikrozentrifugenröhrchen mit TE-Puffer oder Wasser eluiert. Dieses spezielle Modul eliminiert auch das Risiko des Pelletverlustes, zu dem es beim Abgießen des Überstandes nach der Zentrifugation kommen kann.
| Merkmale | HiSpeed Plasmid Midi Kit | HiSpeed Plasmid Maxi Kit |
|---|---|---|
| Anwendungen | Transfektion, Klonierung, Sequenzierung, Gen-Silencing | Transfektion, Klonierung, Sequenzierung, Gen-Silencing |
| Kulturvolumen/Ausgangsmaterial | 50 µl – 150 ml Kulturvolumen | 150 µl – 250 ml Kulturvolumen |
| Plasmidtyp | Cosmid-DNA mit hohem Kopienanteil | Cosmid-DNA mit hohem Kopienanteil |
| Verfahren | Manuell (Filtration) | Manuell (Filtration) |
| Probe pro Lauf | 1 Probe pro Lauf | 1 Probe pro Lauf |
| Technologie | Anionenaustausch-Technologie | Anionenaustausch-Technologie |
| Dauer pro Lauf | 45 min | 60 min |
| Ausbeute | <200 µg | <750 µg |
Verfahren
Neutralisierte Bakterienlysate werden in der QIAfilter Cartridge inkubiert und in Sekundenschnelle durch Filtration bereinigt. Das Filtrat wird für die Aufreinigung der Plasmid-DNA auf ein HiSpeed Tip aufgebracht (siehe Flussdiagramm „QIAGEN Plasmid Kit-Verfahren“). Die eluierte DNA wird mit Isopropanol versetzt und mit der mitgelieferten Spritze auf das QIAprecipitator Modul aufgetragen. Die konzentrierte und entsalzte DNA wird dann aus dem QIAprecipitator direkt in ein Mikrozentrifugenröhrchen mit TE-Puffer oder Wasser eluiert.
Anwendungen
Mit HiSpeed Plasmid Kits aufgereinigte DNA liefert hervorragende Ergebnisse bei allen Anwendungen, von der Klonierung und Sequenzierung bis zur Transfektion und dem plasmidvermittelten Gen-Silencing.
Ergänzende Daten und Abbildungen
QIAprecipitator Modul.